Изменения стабилизации имплантатов при использовании различных методик подготовки ложа: с помощью фрез и пьезохирургических инструментов
Введение
Остеоинтеграция — это биологический процесс, приводящий к формированию непосредственной связи между живой костью и поверхностью имплантата при физиологической нагрузке. Стабилизация имплантата является одним из основополагающих факторов для успешной остеоинтеграции и должна поддерживаться в течение всего периода заживления, чтобы предотвратить микродвижения, которые могут привести к формированию фиброзной ткани вокруг имплантата. Данные научных трудов позволяют предположить, что пороговым значением микроподвижности для формирования соединительнотканной капсулы является 50-150 μ.
Общая стабилизация имплантата может рассматриваться как комбинация первичной и вторичной стабилизации. Первичная имеет механическую природу и зависит от формы и размера имплантата, качества и объема костной ткани пациента и применяемой методики врача. Первичная стабилизация максимальна сразу после установки имплантата вследствие компрессии костных стенок, но уменьшается со временем. Вторичная стабилизация, напротив, отсутствует в момент фиксации имплантата и увеличивается со временем, поскольку является результатом таких биологических процессов в области контакта имплантата с костью, как формирование новой кости и ремоделирование.
Для оценки стабилизации имплантатов на различных этапах остеоинтеграции предлагались различные клинические методики, например: Периотест (Siemens AG, Germany), Дентал Файн Тестер (Kyocera, Japan) и Осстел Ментор (Osstell AB, Sweden). Однако Периотест и Дентал Файн Тестер недостаточно чувствительны, а на результаты измерений существенно влияет расположение точки снятия показаний на абатменте, наклон наконечника и расстояние от наконечника до имплантата по горизонтали.
Осстел Ментор определяет стабилизацию имплантата за счет вычисления разности резонансных частот между тестовым штифтом, завинченным на имплантат, и анализирующим устройством. Магнит на штифте подвергается воздействию электромагнитных импульсов, после чего его колебания оцениваются по шкале от 0 до 100. Эти значения линейно связаны со степенью микроподвижности имплантата. С помощью радиочастотного анализа становится возможным количественно оценить стабилизацию имплантата и ее изменения во времени как силу фиксации имплантата в кости. Основными факторами, влияющими на значения радиочастотного анализа, являются структура кости (наиболее важна толщина кортикальной пластины) и, в меньшей степени, длина имплантата. Значения коэффициента стабильности имплантата (далее КСИ ) не зависят от расположения измерительного прибора: при проведении измерений в двух различных направлениях результаты достоверны и статистически значимы.
На возникающую вторичную стабилизацию оказывают значительное влияние характеристики имплантата и хирургический метод постановки. За прошедшие 20 лет было проведено множество исследований, показавших, что процесс заживления костной ткани зависит от топографии поверхности имплантата: шероховатая поверхность обеспечивает более быструю и эффективную остеоинтеграцию по сравнению с гладкой. Кроме того, в новейших исследованиях доказана роль биоактивных покрытий, которые усиливают остеоинтеграцию за счет аномодификаций поверхности химическими агентами или физическим воздействием. Большой объем исследований посвящен эффективности различных свойств имплантатов, однако крайне мало работ анализируют связь между методиками препарирования ложа под имплантат и реакцией костной ткани, несмотря на то что атравматичное препарирование всегда считалось важным фактором достижения оптимальной остеоинтеграции. В проведенных исследованиях рассматривались такие факторы, как влияние вращающихся фрез (генерация тепла, тип ирригации, износ) и остеотомов, хотя их применение ограничено только костной тканью средней плотности. Появление пьезохирургии открыло новые возможности при проведении остеотомии.
Сегодня эффекты ультразвука широко исследуются в различных областях медицины: в ортопедии они применяются для улучшения заживления при переломах и повреждениях связок за счет усиления пролиферации клеток и синтеза костного матрикса. В других исследованиях доказаны положительное воздействие ультразвука на ангиогенез, а также стимуляция одонтобластов, продуцирующих заместительный дентин и одномоментная активация дифференцировки стволовых клеток пульпы зуба в одонтобласты. По данным мультидисциплинарных клинических испытаний, применение ультразвука в костной хирургии позволяет получать многообещающие результаты за счет высокой точности и безопасности. Более того, в недавних пилотных исследованиях на животных доказано, что пьезохирургические инструменты являются более эффективными по сравнению с вращающимися и ведут к лучшему заживлению костной ткани в пародонтологии и имплантологии: разрез, выполненный при помощи ультразвука, вызывает раннее повышение уровней BMP-4 (костный морфогенетический белок-4) и TGF-2 (трансформирующий фактор роста-β2), контролирует воспалительный процесс и стимулирует ускоренное ремоделирование костной ткани.
Целью данного исследования являлась оценка изменений стабилизации имплантатов, установленных с применением вращающихся и пьезоэлектрических инструментов, в течение длительного времени (90 дней после установки имплантатов). Нулевой гипотезой исследования было отсутствие различий в стабилизации имплантатов, установленных с использованием различных методик, на ранних фазах заживлению.
Материалы и методы исследования
Испытуемая группа
В данном рандомизированном, контролируемом пилотном исследовании принимали участие 20 взрослых пациентов, которым было необходимо установить по два имплантата в области премоляров верхней челюсти.
Условием включения являлось заживление области планируемой имплантации в течение шести месяцев после операции удаления зуба без процедур восстановления объема костной ткани. Пациенты не носили съемных протезов.
На первичном приеме осуществлялись клиническое обследование и оценка ортопантомограмм участников исследования. Далее проводили восковое моделирование ортопедической конструкции и компьютерную томографию с шаблоном для оценки предполагаемого места установки имплантата. Способ подготовки ложа для имплантата (группа оценки или контрольная группа) выбирался случайным образом при помощи компьютерной программы, использующей алгоритм блочной рандомизации.
Лечение
Все имплантаты установлены одним врачом, владеющим традиционными и ультразвуковыми методиками. За один час до операции пациенты принимали по две таблетки амоксициллина с клавулановой кислотой (аугментин). Под местной анестезией (артикаин 4% с эпинефрином 1 : 100 000) был отслоен полнослойный слизисто-надкостничный лоскут и подлежащая кость подготовлена для остеотомии. После откидывания лоскута открывался конверт, в котором было указано, какой тип операции должен проводить хирург. Два ложа соседних имплантатов препарировались у каждого пациента в ходе единой операции: в контрольной группе Б формирование проводили фрезами, в группе оценки А – пьезоэлектрическими инструментами Piezosurgery, Mectron (рис. 1). При работе всеми инструментами соблюдались рекомендации производителя. Каждая фреза или ультразвуковая насадка использовались не более шести раз (у трех пациентов).
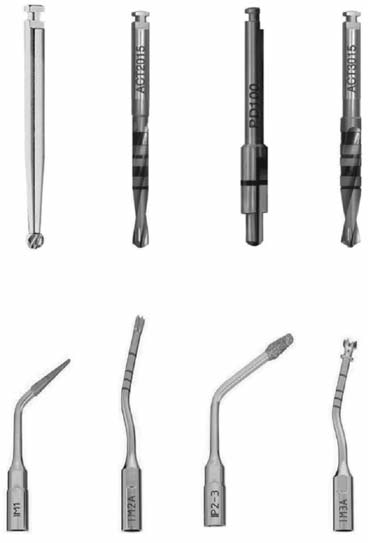
Рис. 1. Типы и последовательность вращающихся и ультразвуковых инструментов, использованных при формировании ложа для имплантанта
В обеих группах препарирование заканчивали на инструменте, имеющем диаметр 3 мм, дальнейшее уплотнение костной ткани не проводилось. Сразу после установки имплантатов независимый исследователь трижды фиксировал коэффициент стабилизации имплантатов с мезио-дистальной, дисто-мезиальной, щечно-язычной и язычно-щечной проекций. Использовались одноразовые тестовые штифты и аппарат Осстел Ментор, калибровка которого проводилась до и после каждого пациента с помощью имплантата, фиксированного в пластмассовый блок.
Дополнительно в обеих группах засекалось время хирургической операции от перфорации кортикальной пластины до момента установки имплантата в окончательное положение.
Лоскут укладывали на место, края раны ушивали полиамидным псевдомонофиламентным материалом (супрамид); имплантаты оставляли открытыми, с установленными на них формирователями десны (крутящий момент – 10 Н/см). Пациентам прописывали ибупрофен 600 мг, при необходимости, и полоскание полости рта 0,2% раствором хлоргексидина в течение одной минуты дважды в день.
Швы снимали через семь дней после операции. Независимый исследователь трижды фиксировал коэффициент стабильности имплантата по описанному протоколу через 7, 14, 21, 28, 42, 56 и 90 дней. Помимо этого, на каждом приеме все имплантаты оценивались на предмет подвижности, боли, признаков воспаления.
Через пять месяцев на все имплантаты были установлены индивидуальные абатменты и металлокерамические коронки. Все пациенты наблюдались у стоматолога на протяжении года после операции.
Статистический анализ
Стабилизация каждого имплантата в каждый промежуток времени описывалась значением КСИ (среднее из 12 измерений), для оценки равномерности распределений значений применялся коэффициент согласия Колмогорова-Смирнова. Результаты внутри группы подвергались дисперсионному анализу (ANOVA), сравнение между группами проводили при помощи критерия Стьюдента для одной выборки при уровне значимости 0,05.
Результаты
20-ти пациентам (12 мужчин, 8 женщин в возрасте от 41 до 81 года, средний возраст 59,7 ± 13,6 лет) установили 40 имплантатов в области премоляров верхней челюсти. Пациентов, выбывших из исследования, не было. Через 90 дней после установки, 39 из 40 имплантатов имели признаки полной остеоинтеграции (одно отторжение в контрольной группе Б на 21-й день). Помимо отторгшегося имплантата, других местных или общих побочных реакций не выявлено.
КСИ, определяемый трижды, показал высокий уровень достоверности (разброс составил менее 2% для одного имплантата). Различия в среднем КСИ между значениями в группе А (72,2 ± 5,8) и в группе Б (70,5 ± 5,8) были статистически незначимыми (р = 0,3215). Максимальное и минимальное значения КСИ , зафиксированные сразу после установки имплантатов в группах А и Б, составили 84-58 и 83-56, соответственно. Средние значения в разные промежутки времени статистически значимы и представлены на рис. 2-4.
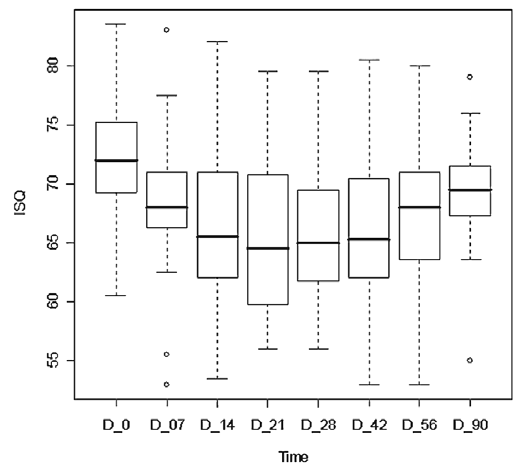
Рис. 2. Значения коэффициента стабилизации имплантата (КСИ) в группе вращающихся инструментов в различные моменты времени
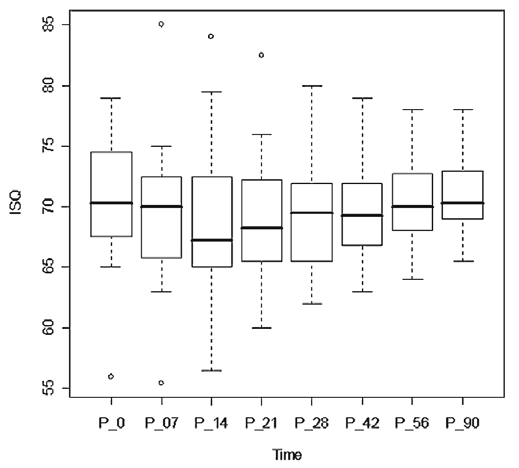
Рис. 3. Значения коэффициента стабилизации имплантата (КСИ) в группе ультразвуковых инструментов в различные моменты времени
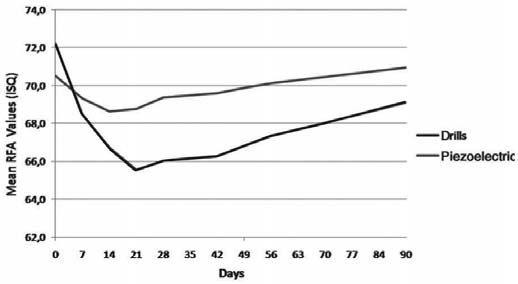
Рис. 4. Изменения значений коэффициента стабилизации имплантата (КСИ) обеих группах на протяжении 90 дней после имплантации
Результаты дискретного анализа, проведенного в каждой группе, показали, что разброс значений КСИ в группе вращающихся фрез был значительно больше случайного (р < 0,0001), в то время как в группе пьезоинструментов он не был статистически значимым (р = 0,1142).
В обеих группах отмечалось снижение КСИ в течение первого периода после имплантации. Самое низкое значение зафиксировано на 21-й день в группе Б (среднее значение КСИ : 65,6 ± 7,2 – 90,8% от первичной стабилизации) и на 14-й день — в группе А (среднее значение КСИ : 68,6 ± 6,5 – 97,3% от первичной стабилизации). Спустя три недели значения КСИ увеличивались в обеих группах, причем в тестовой группе А на 90-й день они превысили исходные. Значения КСИ на 90-й день варьировали от 79 до 55 — в группе Б и от 80 до 64 — в группе А. Анализ потери стабилизации (процент снижения среднего КСИ относительно первичной стабилизации) продемонстрировал статистически значимые различия между двумя группами на протяжении всего периода наблюдения. В период с 14-го по 42-й день, в частности, разница была статистически значима (р < 0,0001). Рис. 5 отображает тенденции изменения стабилизации имплантатов.
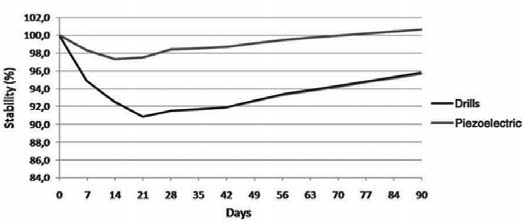
Рис. 5. Изменение коэффициента стабильности имплантата (КСИ) в обеих группах на протяжении 90 дней после имплантации, %
Среднее время, затраченное на хирургические манипуляции от момента перфорации кортикальной пластины до окончательного позиционирования имплантата, составило 6,00 мин. (95% доверительный интервал, границы 5,45 и 6,55) для фрез и 7,15 мин. (95% доверительный интервал, границы 6,74 и 7,56) — для пьезохирургических инструментов. Различия между группами статистически значимы (р < 0,01).
На контрольном осмотре, через год после установки, все 39 имплантатов были функциональны.
Обсуждение
Целью данного исследования являлась долгосрочная оценка изменений стабилизации имплантатов, ложе для которых было подготовлено с использованием вращающихся или ультразвуковых инструментов.
В этой работе мы стремились минимизировать все факторы, влияющие на первичную стабилизации имплантатов, для того чтобы оценить влияние применяемой методики на процесс заживления.
Мы использовали имплантаты, идентичные по диаметру, длине, макро- и микротопографии. Место установки имплантатов (область премоляров верхней челюсти) и ход операции (один и тот же хирург, одинаковые диаметры инструментов в обеих группах) также были максимально стандартизованы для объективизации конечных результатов.
Радиочастотный анализ был выбран как неинвазивный и надежный метод оценки изменения стабилизации импланатов с течением времени, данные которого напрямую связаны со степенью фиксации имплантата в окружающей кости. Увеличение значений КСИ в процессе заживления, по-видимому, отражает аппозиционный рост костной ткани на поверхности имплантата.
Средние значения КСИ в обеих группах фиксировались сразу и через 90 дней после установки имплантатов, что соответствует нормам, принятым в других исследованиях имплантатов с параллельными стенками.
Стабилизация имплантатов в обеих группах в начале исследования была сравнима (р >0,05) и снижалась в первом периоде заживления. Во многих исследованиях показано, что в течение первых трех недель процессы моделирования и ремоделирования кости, прилежащей к поверхности имплантата, приводят к снижению КСИ (предполагается, что существует временной интервал между первичной и вторичной стабилизацией, в течение которого подвижность имплантата может увеличиваться: после формирования первичной механической стабильности за счет резьбы имплантата перед окончательной остеоинтеграцией на короткий промежуток времени появляется резорбция, которая может снижать механическую стабилизацию имплантата). Наличие подобной точки перехода от уменьшения к увеличению стабилизации предполагает изменение метаболических процессов от преимущественно резорбтивных — к преимущественно продуктивным.
В данном исследовании в контрольной группе Б пик наименьших значений КСИ был отмечен на 21-й день (снижение на 9,2% от первичной стабилизации), что соответствует результатам, полученным другими исследователями при традиционной методике препарирования ложа под имплантат. В группе оценки А наименьшие значения КСИ отмечались через 14 дней после имплантации (первичная стабилизация снизилась на 2,7%) с применением пьезохирургической методики.
Более того, с течением времени изменения КСИ в контрольной группе Б (фрезы) были значительно больше случайных (p < 0,0001), а в тестовой группе А (ультразвук) – напротив (p = 0,1142). На основании вышеизложенных данных мы опровергаем нулевую гипотезу исследования. Другими словами, различия в стабилизации имплантатов из групп А и В статистически значимы на протяжении всего исследования. В частности, значимым является более раннее и менее выраженное снижение КСИ при применении пьезоинструментов, что позволяет предположить менее выраженную фазу воспаления и резорбции за счет меньшей травмы костной ткани по сравнению с фрезами.
Результаты схожи с полученными в ходе сравнительного исследования данными и свидетельствуют о формировании более плотной костной ткани и выраженном остеогенезе вокруг имплантатов при подготовке ложа ультразвуковыми насадками, по сравнению с фрезами.
Классический каскад реакций при восстановлении поврежденной кости начинается с острого воспалительного ответа и клеточного хемотаксиса, приводящих к образованию васкуляризованной грануляционной ткани и пролиферации плюрипотентных мезенхимальных клеток с возможностью дифференцироваться в предшественники остеобластов.
На ранних этапах заживления макрофаги и полиморфноядерные клетки уничтожают остатки костной стружки, остающиеся на стенках ложа после вращающего инструмента и препятствующие доступу к костным лакунам. Возможная интерпретация полученных нами результатов может основываться на очищающем воздействии ультразвуковых насадок: микровибрации и эффекте кавитации в физиологическом растворе, что, вероятно, приводит к эффективному удалению костных опилок и остаточных тканей в области ложа для имплантата, освобождая таким образом костные лакуны для быстрой миграции клеток-предшественников остеобластов.
Необходимо отметить, что результаты данного пилотного исследования должны оцениваться с осторожностью ввиду определенных ограничений. Обобщая результаты, следует учесть следующие переменные: проведение хирургических манипуляций одним врачом, малый размер выборки и определенное место установки имплантатов (исключительно боковой отдел альвеолярного отростка верхней челюсти). Более того, клиническую значимость изменений КСИ все еще необходимо доказать. Формирование ложа для имплантата с использованием фрез проходило значительно быстрее по сравнению с пьезохирургической методикой, но клинического значения снижение времени операции на 1 минуту не имеет.
Однако данные нашего исследования указывают на наличие определенной тенденции, а повторяемость и высокая статистическая достоверность результатов должны способствовать проведению новых расширенных испытаний для определения возможностей и ограничений «ультразвуковой остеоинтеграции».
Выводы
Результаты проведенного пилотного исследования позволяют предположить, что ультразвуковая подготовка ложа для имплантата изменяет ход остеоинтеграции, что проявляется в меньшем снижении коэффициента стабилизации имплантата и более раннем переходе с уменьшения на повышение стабилизации по сравнению с традиционной методикой препарирования фрезами.
Необходимы дальнейшие клинические и долговременные исследования для оценки и внесения полной ясности в процессы остеоинтеграции после ультразвукового вмешательства и возможные клинические преимущества данной методики при немедленной и ранней нагрузке.
Авторы
Claudio Stacchi
DDS, MSc, Contract professor, Department of Biomedicine, University of Trieste, Trieste, Italy
Tomaso Vercellotti
MD, DDS, honorary professor, Eastman Dental Institute, London, UK
Lucio Torelli
DSc, associate professor, Department of Mathematics and Informatics University of Trieste, Trieste, Italy
Fabio Furlan
DDS, MSc, Private practice, Monfalcone, Italy
Roberto Di Lenarda
DDS, MSc, Professor, Orthodontic, Departemnt Faculty of Dentistry University of Trieste, Trieste, Italy
Резюме
Статья посвящена вопросам изменения стабилизации имплантатов при использовании различных методик подготовки ложа.
Ключевые слова
клиническое исследование, имплантаты, пьезохирургические инструменты.
Рандомированное, контролируемое клиническое исследование




Комментарии и отзывы